|
转自:安必平 摘要:Nectin-4作为肿瘤相关抗原,在尿路上皮癌、乳腺癌等多种恶性肿瘤中过表达,已被证实通过调控细胞增殖、运动迁移和侵袭等过程参与肿瘤发展进程。尿路上皮癌中Nectin-4的表达定位(胞膜vs胞浆)和阈值差异会影响靶向药物EV的疗效。EV的敏感性由NECTIN-4表达介导,而该基因在膀胱癌管腔亚型中高表达,而胞浆表达会带来假阳性疗效。并且,NECTIN-4扩增是转移性尿路上皮癌(mUC)中常见的基因组事件(约占25%患者),NECTIN-4扩增与膜NECTIN-4蛋白表达水平显著相关,且与EV单药治疗的客观缓解率高度相关(>90%,27/28)。我司已开发有NECTIN-4的FISH探针,可为NECTIN-4ADC药物研究提供更精准的研究工具。 Nectin-4与ADC(抗体药物偶联物) Nectin-4(又称PVRL4或脊髓灰质炎病毒受体相关蛋白4)是黏附分子nectin家族的成员,被认为能够介导钙离子非依赖性的细胞间黏附,这一过程主要发生在粘着连接处。细胞间黏附是指相邻细胞通过黏附分子(CAM)相互作用的过程,调控细胞信号传递、运动迁移、组织生长发育等重要生物学活动。该过程异常可导致神经系统疾病和癌症等多种疾病。 Nectin-4基因定位于1q23.3染色体的PVRL4基因编码Nectin-4。Nectin-4在人类胚胎组织中高表达,但在健康成人组织中罕见。既往研究证实,Nectin-4的mRNA在皮肤、膀胱、唾液腺、食管、乳腺和胃等多种正常组织中表达水平较低,但在多种恶性肿瘤中显著表达。根据癌症基因组图谱(TCGA)数据,Nectin-4基因表达在多数实体瘤中普遍存在,表达率最高的癌症包括:膀胱癌(17%)、胆管癌(14%)、肝细胞癌(12%)、乳腺癌(9%)、肺腺癌(7%)。这种在肿瘤组织中的选择性表达使其成为肿瘤靶向抗肿瘤药物的理想靶点。然而,Nectin-4表达下调与肿瘤转移进展及靶向Nectin-4治疗的耐药性相关。
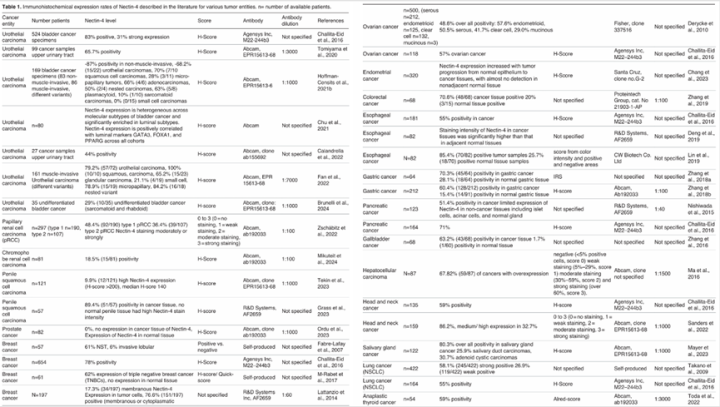
如上图:Nectin-4在众多实体肿瘤中的IHC表达研究,及所选用的抗体克隆号和评分标准。(HistolHistopathol,2025,40:785-796)
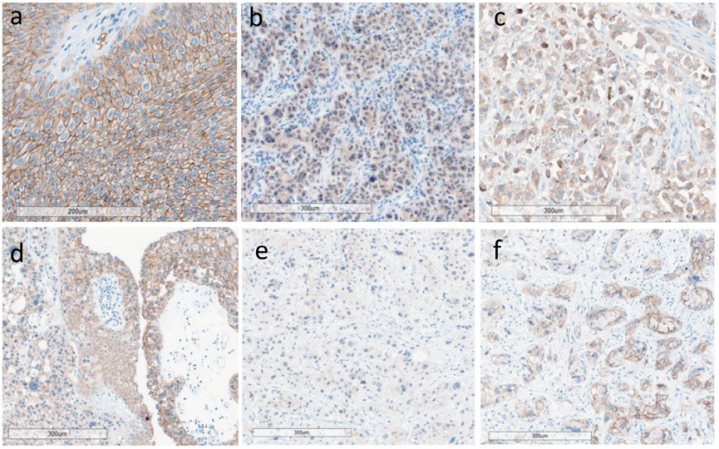
如上图:Nectin-4染色示例图像。a.输尿管尿路上皮癌:强膜染色;b.膀胱尿路上皮癌:中等强度胞质染色,无膜染色;c.膀胱尿路上皮癌(部分微乳头状组织学亚型):不完全膜染色伴中等胞质染色。d-f.膀胱尿路上皮癌(Nectin-4异质性染色);d(右):非浸润性乳头状尿路上皮癌,强膜染色;d(左):间质浸润性尿路上皮癌,中等膜染色;e/f:同一间质浸润性肿瘤不同区域,显示无/弱膜染色(e)或中-强膜染色(f)。
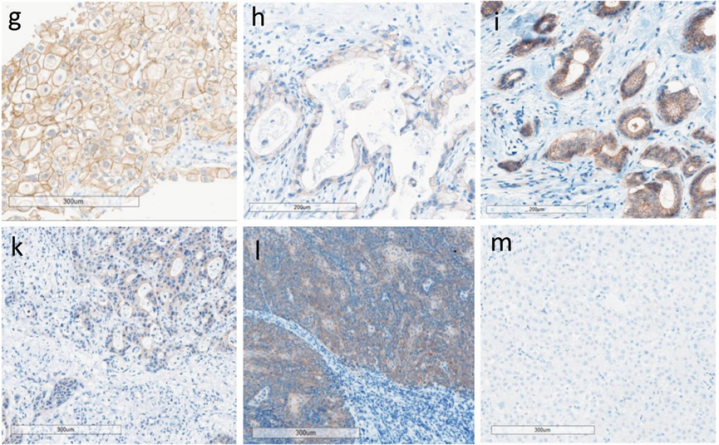
如上图:Nectin-4染色示例图像。g.伴肺转移的尿路上皮癌:强膜染色;h.集合管癌:弱-中度膜染色;i.乳腺癌(非特殊类型):强膜染色;k.结直肠癌肝转移:弱胞质染色,无膜染色;l.p16阳性扁桃体鳞癌:中度胞质染色,无膜染色;m.肝细胞癌:Nectin-4阴性。 抗体偶联药物(ADCs)作为一种新型靶向癌症疗法,通过将单克隆抗体的特异性与传统化疗的细胞毒性相结合,已在多种实体瘤中展现出改变临床实践的治疗效果。其中,靶向NECTIN-4的ADC药物enfortumabvedotin(EV)在尿路上皮癌和乳腺癌中积累了较多研究数据。EV是一种抗体偶联药物,由全人源化抗Nectin-4单抗通过可裂解连接子与微管抑制剂MMAE偶联而成。该药物已获批用于PD-1/L1抑制剂和含铂化疗进展后的局部晚期或转移性尿路上皮癌患者。深入理解Nectin-4的免疫调节作用以及EV等药物活性机制和耐药原理,将为未来Nectin-4靶向疗法的开发提供关键科学依据。
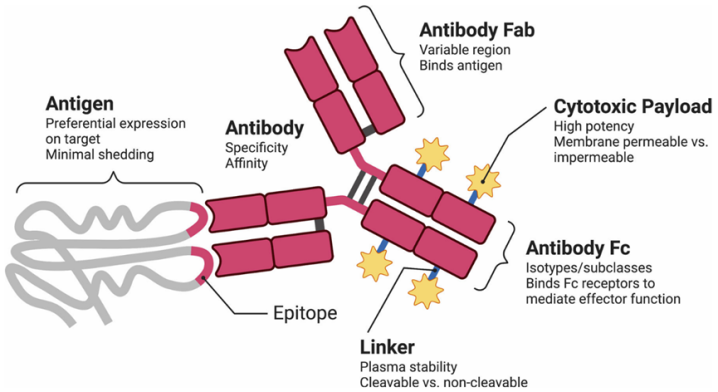
如上图:抗体药物偶联物(ADC)及其与靶抗原相互作用的结构图示。图中重点标注了靶点选择及各组件(抗体、连接子和细胞毒性载荷)设计的关键要素:(1)抗体部分:除抗原结合的Fab结构域外,Fc结构域可能通过免疫效应细胞相互作用及药代动力学特性调节影响ADC整体活性;(2)连接子:连接抗体与细胞毒性药物的化学键;(3)细胞毒性载荷:发挥抗肿瘤作用的有效成分。(ExpertOpinBiolTher.2021.21(7):863–873.) EV(EnfortumabVedotin)最初于2021年基于EV-101试验中44%的显著缓解率,获得FDA批准用于治疗铂类和免疫检查点抑制剂难治性转移性尿路上皮癌,随后于2022年4月13日获得EMA批准。接着,EV联合帕博利珠单抗的方案被批准用于未经治疗且不适合顺铂治疗的患者。近期,由于EV-302研究显示该联合疗法优于铂类化疗,它已成为一线治疗的选择之一。在这项关键研究中,Nectin-4表达被证实"几乎普遍存在"(96.7%,147/152),因此后续试验中取消了Nectin-4表达的检测,EV的应用无需评估其表达水平。但是,EV-101临床试验中使用的抗体克隆M22-321b41.1,以及Challita-Eid团队使用的克隆M22-244b3(均由EV专利持有者Agensys公司开发),目前尚未商业化。并且,Nectin-4表达与组织学亚型、既往治疗或EV总体缓解率之间的关系尚未在前瞻性试验中得到明确描述。 Nectin-4表达争议:表达定位和阈值差异会影响疗效 EV-101是支持EnfortumabVedotin(EV)获批的关键I期临床试验,其采用H-score系统评估Nectin-4表达,定义H-score>150为“强表达”,并基于此认为Nectin-4在尿路上皮癌(UC)中“普遍高表达”(96.7%阳性率)。 H-score(Histochemicalscore)是一种半定量评分,结合染色强度(Intensity)和阳性细胞比例(Percentage)。染色强度分级:0:无染色;1+:弱染色(肉眼可见但微弱);2+:中等染色(清晰可见);3+:强染色(深染)。阳性细胞比例:评估每张切片中1+/2。+/3+染色的肿瘤细胞占比(0-100%)。H-score计算公式:H-score=(1+细胞%×1)+(2+细胞%×2)+(3+细胞%×3)。H-score值范围介于0-300(300表示所有细胞均为3+强染色)。 EV-101的评分特点:未区分膜性/胞质染色,而是将任何形式的Nectin-4染色(膜、胞质或混合)均计入评分。并且,将H-score≥150,定义为“强表达”,用于患者入组,从而得出96.7%患者符合标准,导致“普遍高表达”的结论。此评分方式得出的高评分可能包含大量无效的胞质染色,但ADC需要膜结合才能内化药物,从而导致部分高评分患者用药无效。并且,EV-101纳入的多为经典型尿路上皮癌,而真实世界中变异亚型(如肉瘤样、小细胞癌)表达率显著更低。所以,EV-101评分未考虑染色定位、肿瘤亚型,可能高估了靶点的可用性。 基于此背景,Klümper等(ClinCancerRes2023)对EV-101的结论提出挑战。作者们进行多中心合作,研究整合了来自德国多个医疗中心的临床样本与数据(作者列表涵盖28位合作者),增强了结论的普适性。并且进行标准化检测,采用经过验证的商业化抗体(AbcamEPR15613-68克隆)和CRISPR-Cas9基因编辑模型,确保NECTIN-4定位(膜/胞质/核)检测的特异性。 其采用更严格的膜特异性评分:膜性H-score>100。研究发现:仅膜性H-score>100的患者对EV治疗反应显著更优,ORR70%vs.20%;转移灶中Nectin-4表达下降(占59.1%病例),与耐药相关。其改进了Nectin-4的评分方法:(1)染色定位区分。仅膜性染色计入评分,排除纯胞质染色;要求连续、完整的膜线性染色(Circumferentialmembranousstaining)。(2)调整H-score阈值。膜性H-score>100定义为“治疗有效阈值”,计算方式与EV-101相同,但仅统计膜染色细胞。基于此改进,显现出更佳的临床相关性:膜H-score>100组:ORR70%,中位PFS5.8个月;而膜H-score≤100组的ORR为20%,中位PFS2.1个月(p 并且,作者发现转移灶表达丢失现象:59.1%的转移病例显示Nectin-4表达较原发灶下降(H-score降低);仅19%病例表达增加,其余稳定;并且,膜性表达丢失更显著,如肺转移灶中膜染色减少80%。 ChuCE等人的研究(ClinCancerRes.2021.27(18):5123–5130.)也显示EV的敏感性由NECTIN-4表达介导,而该基因在膀胱癌管腔亚型中高表达。作者们利用7个肌层浸润性膀胱癌临床队列(共1,915例标本)的分子分型及NECTIN4表达数据,评估NECTIN4在分子亚型中的表达差异。转录组分析的主要结果为膀胱癌共识分子亚型中NECTIN4的相对表达水平。此外,在膀胱癌细胞系中验证了NECTIN4的表达,并通过稳定过表达或敲低基底型和管腔型细胞系中的NECTIN-4,结合细胞增殖及克隆形成实验检测EV的药物敏感性。结果显示,NECTIN-4表达在膀胱癌各分子亚型中具有异质性,且在管腔亚型中显著富集。所有队列中,NECTIN-4表达与管腔标志物GATA3、FOXA1和PPARG呈正相关。在膀胱癌的管腔型和基底型细胞中,NECTIN-4表达不仅是EV敏感性的必要条件,还具有充分性;其下调会导致EV耐药。
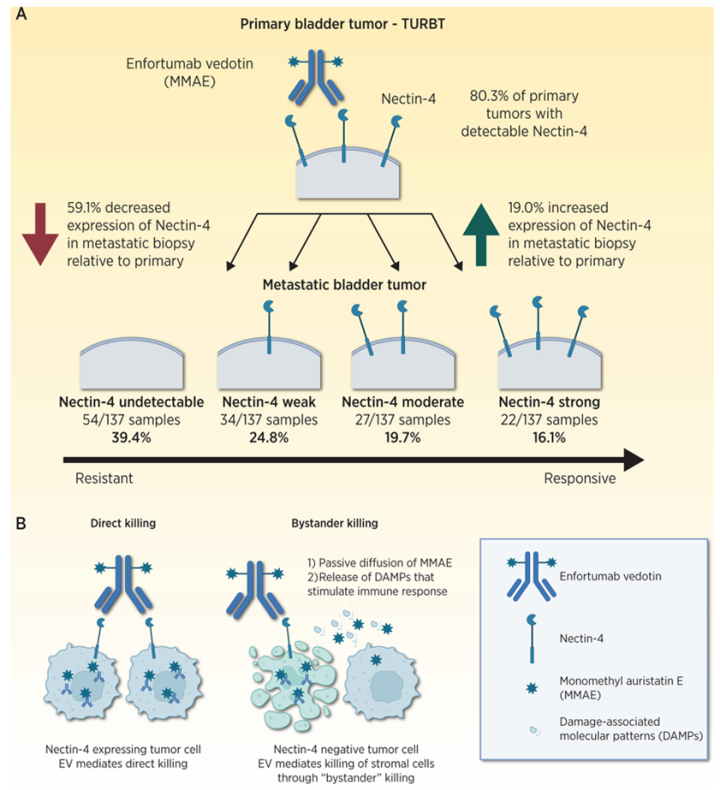
如上图:Nectin-4细胞表面表达随转移进展的变化。(A)Klümper等人对原发肿瘤样本中nectin-4表达的定量分析显示,80.3%的原发肿瘤可检测到nectin-4表达。在配对转移灶活检中,大多数肿瘤的nectin-4表达(H-Score评分)降低(59.1%),部分肿瘤表达增加(19.0%)。图1A底部展示了转移灶中nectin-4表达的四分位定量分析。(B)Nectin-4表达使enfortumabvedotin能够结合并递送单甲基奥瑞他汀E(MMAE)有效载荷(左图)。间质细胞的nectin-4表达可能介导对nectin-4阴性肿瘤细胞的"旁观者杀伤"效应(右图)。 争议的核心:为何表达定位和阈值差异会影响疗效? (1)膜表达是ADC起效的前提。EV需通过Nectin-4膜结合内化,释放MMAE杀伤细胞。胞质表达无法介导此过程。EV-101的高评分可能包含大量“假阳性”,胞质染色患者用药无效。(2)动态表达的临床意义。Klümper研究显示,转移灶膜表达下降(H-score降低)患者进展更快,提示靶点丢失是耐药机制。(3)标准化需求。不同抗体(如Agensysvs.Abcam)对膜染色的敏感性不同,需统一检测流程。 EV-101的“普遍高表达”结论因未区分膜/胞质染色可能高估靶点可用性,而Klümper研究证明仅膜性H-score>100才是疗效关键。这一争议凸显了ADC靶点检测标准化的紧迫性。在未来方向上,Nectin-4的表达需继续优化评分标准。(1)推荐膜特异性评分,仅评估连续膜线性染色,排除胞质信号。(2)调整阈值。膜H-score>100可能更适合预测EV疗效,此标准仍需前瞻性验证。(3)数字化病理辅助:采用AI定量分析膜染色比例与强度,减少主观偏差。 Nectin-4基因拷贝数变异(CNA):也与EV治疗反应相关 另一个具有前景的生物标志物是NECTIN-4拷贝数变异(CNA)状态。在TCGA队列中,NECTIN-4扩增在多种实体瘤中频繁发生,尤其在膀胱癌(TCGA-BLCA,17%)、乳腺癌(TCGA-BRCA,5–10%)和肺腺癌(TCGA-LUAD,5–10%)中。有研究发现,NECTIN-4扩增是转移性尿路上皮癌(mUC)中常见的基因组事件(约25%的患者肿瘤中存在)。值得注意的是,NECTIN-4扩增与膜NECTIN-4蛋白表达水平显著相关。在108例接受EV单药治疗的mUC患者中,28例存在NECTIN-4扩增的患者中27例(>90%)对治疗产生客观缓解(包括14%的完全缓解),而无扩增亚组的客观缓解率仅为32%。多变量Cox分析显示,NECTIN-4扩增与死亡风险降低92%显著相关(风险比0.08,95%置信区间0.02–0.34;p
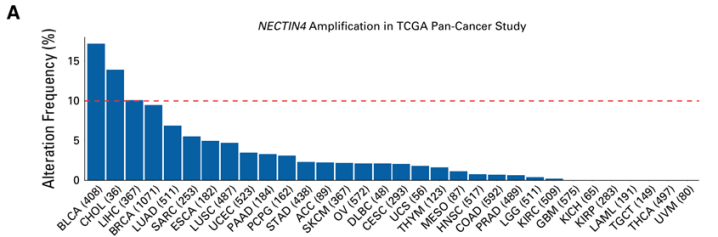
如上图:KlümperN等人的多中心NECTIN-4基因扩增研究数据(JClinOncol,2024,00:1-10)。数据显示,NECTIN4基因扩增在肌层浸润性膀胱癌和转移性尿路上皮癌(mUC)中呈现较高的发生率,在本研究的mUC队列中,这一比例达到约26%。TCGA泛癌分析还发现,NECTIN4扩增在其他恶性肿瘤中也较为常见,如在乳腺癌和肺癌患者中的发生率约为5%-10%。然而,在未接受EV治疗的mUC患者群体中,NECTIN4扩增状态与临床结局并无显著相关性。这些发现提示NECTIN4扩增可能成为预测EV治疗疗效的重要生物标志物。 通过临床常用的荧光原位杂交(FISH)技术即可评估NECTIN-4扩增状态。这一标志物有助于识别对EV单药或EV/P联合疗法反应极佳的患者,甚至可能为治疗降级提供依据;而缺乏NECTIN-4扩增且膜表达阴性/低表达的患者,可能更适合GC+纳武利尤单抗(CheckMate901)、含铂化疗联合阿维鲁单抗维持(JAVELINBladder100)或靶向TROP2/Her2等新型ADC疗法。在未来,必须开展更有针对性的生物标志物研究,以精准识别EV/EV-P的最佳获益人群,同时筛选高风险无效患者,这类患者可能需要转向化疗免疫联合方案或其他靶点ADC。
如上图:NECTIN-4扩增在实体瘤中普遍存在。(A)展示了10,712例样本/患者、涵盖32项研究中NECTIN-4扩增的发生频率,其中膀胱尿路上皮癌(BLCA)的检出率最高(17%)。
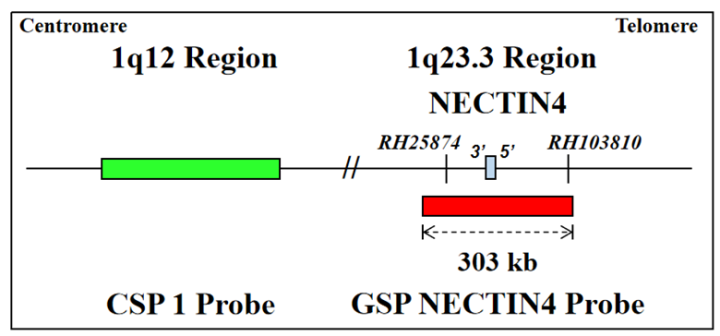
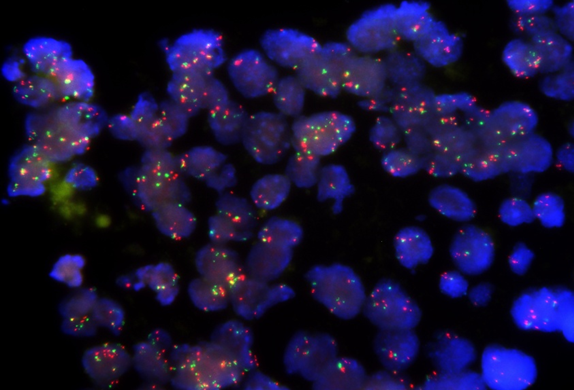
如上图:我司开发的NECTIN-4FISH探针。
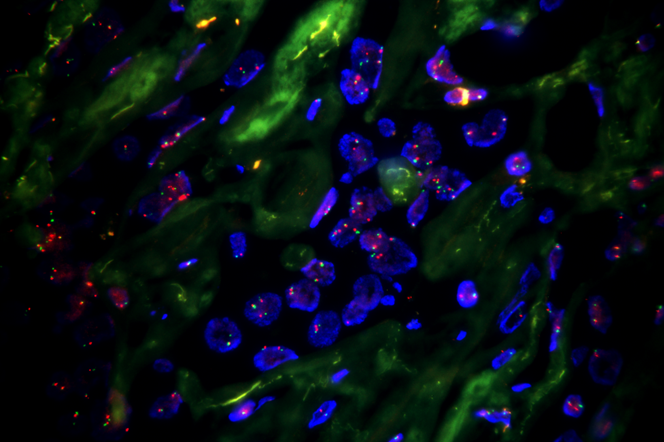
如上图:我司NECTIN-4FISH探针在一例尿路上皮癌样本中的检测图。NECTIN-4平均拷贝数:3.64;NECTIN-4/1q12比值:1.21。
如上图:我司NECTIN-4FISH探针在一例乳腺癌样本中的检测图。NECTIN-4平均拷贝数:6.28;NECTIN-4/1q12比值:2.11。 向上滑动阅览 部分参考文献 1.ChuCEetal.HeterogeneityinNECTIN4expressionacrossmolecularsubtypesofurothelialcancermediatessensitivitytoenfortumabvedotin.ClinCancerRes.2021,27(18):5123-5130. 2.KlümperN&EcksteinM.BiomarkersofResponsetoAnti-NECTIN4Antibody-DrugConjugateEnfortumabVedotininUrothelialCancer.EuropeanUrologyFocus,2024,10:224-226. 3.KlümperN,etal.MembranousNECTIN-4expressionfrequentlydecreasesduringmetastaticspreadofurothelialcarcinomaandisassociatedwithenfortumabvedotinresistance.ClinCancerRes,2023,29:1496–505. 4.SandersC&KristiansenG.AssessingtheexpressionofNectin-4insolidtumorsbyimmunohistochemistry–whatdoweknow?HistolHistopathol,2025,40:785-796. 5.KlümperN,etal.NECTIN4AmplificationIsFrequentinSolidTumorsandPredictsEnfortumabVedotinResponseinMetastaticUrothelialCancer.JClinOncol,2024,00:1-10. |